PROCESOS TERMODINÁMICOS.

A cualquier transformación en un sistema, desde un estado de equilibrio a otro, se le conoce como proceso. Dicho en otras palabras, es el cambio de estado de una sustancia o un sistema, desde unas condiciones iniciales (estado inicial) hasta unas condiciones finales (estado final) por una trayectoria definida. Por lo tanto, para describir completamente un proceso se requiere de los estados de equilibrio inicial y final, así como de la trayectoria o las interacciones del sistema con su entorno durante el proceso.
En física, se denomina proceso termodinámico a la evolución de
determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a
un determinado sistema físico. Desde el punto de vista de la termodinámica,
estas transformaciones deben transcurrir desde un estado de equilibrio inicial
a otro final; es decir, que las magnitudes que sufren una variación al pasar de
un estado a otro deben estar perfectamente definidas en dichos estados inicial
y final. De esta forma los procesos termodinámicos pueden ser interpretados
como el resultado de la interacción de un sistema con otro tras ser eliminada
alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren
en equilibrio (mecánico, térmico y/o material) entre sí.
determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a
un determinado sistema físico. Desde el punto de vista de la termodinámica,
estas transformaciones deben transcurrir desde un estado de equilibrio inicial
a otro final; es decir, que las magnitudes que sufren una variación al pasar de
un estado a otro deben estar perfectamente definidas en dichos estados inicial
y final. De esta forma los procesos termodinámicos pueden ser interpretados
como el resultado de la interacción de un sistema con otro tras ser eliminada
alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren
en equilibrio (mecánico, térmico y/o material) entre sí.
PROCESO ADIABATICO.

En termodinámica:
En Física.
- Que no permite el intercambio de calor•Que está aislado térmicamente•Que está totalmente aislado del exterior
Las variaciones de volumen o presión de un cuerpo sinaumento o disminución de calor, es decir, no intercambia calor con su entorno. Un procesoadiabático que es además reversible se conoce comoproceso isotrópico.
El calentamiento y enfriamiento adiabático son
procesos que comúnmente ocurren
debido al cambio en la presión de un gas.
Esto puede ser cuantificado usando la ley de los gases ideales.
Un gas, al dilatarse adiabáticamente,procesos que comúnmente ocurren
debido al cambio en la presión de un gas.
Esto puede ser cuantificado usando la ley de los gases ideales.
se enfría, pues la cantidad de calor que contiene se reparte en un volumen mayor; por
el contrario, la compresión adiabática
de dicho gas tiene
por efecto un aumento de su temperatura.
PROCESO ISOCORO O ISOCORICO.

Un proceso isocórico, también llamado proceso isométrico o
isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el
proceso no realiza trabajo presión-volumen, ya que éste se define
como: Z=PΔV; donde P es la presión (el
trabajo es positivo, ya que es ejercido por el sistema).
isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el
proceso no realiza trabajo presión-volumen, ya que éste se define
como: Z=PΔV; donde P es la presión (el
trabajo es positivo, ya que es ejercido por el sistema).
Aplicando la primera ley de la termodinámica, podemos
deducir que Q, el cambio de la energía interna del sistema es: Q=ΔU, para un
proceso isocórico: es decir, todo el calor que
transfiramos al sistema quedará a su energía interna, U. Si la cantidad de gaspermanece
constante, entonces el incremento de energía será proporcional al incremento detemperatura,
Q=nCVΔT, donde CV es el calor específico molar a volumen constante.deducir que Q, el cambio de la energía interna del sistema es: Q=ΔU, para un
proceso isocórico: es decir, todo el calor que
transfiramos al sistema quedará a su energía interna, U. Si la cantidad de gaspermanece
constante, entonces el incremento de energía será proporcional al incremento detemperatura,
PROCESO ISOBÁRICO.
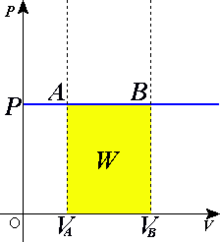
un proceso termodinámico que
ocurre a presión constante. En él, el calor transferido a presión constante está relacionado con el resto de variables mediante:
,
Donde:
= Calor transferido.
= Energía Interna.
= Presión.
= Volumen.
En un diagrama P-V, un proceso isobárico aparece como una línea
horizontal. Si la presión no cambia
durante un proceso, se dice que éste es isobárico.
PROCESO ISOTÉRMICO.

Se denomina proceso isotérmico o proceso isotermo al cambio de temperatura reversible en un sistema termodinámico, siendo dicho cambio de temperatura constante en todo el sistema.
La compresión o expansión de un gas ideal en
contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la
energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la
energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
No hay comentarios.:
Publicar un comentario